Theo thông tin từ Sở Y tế Hà Nội, Sở này đã yêu cầu các cơ sở y tế công lập trực thuộc ngành, các cơ sở y tế ngoài công lập, doanh nghiệp Kinh doanh thuốc, các cơ sở bán lẻ thuốc trên địa bàn không được sử dụng thuốc Arimidex 1mg, thuốc Iressa 250mg không rõ nguồn gốc xuất xứ; tuân thủ việc kinh doanh, mua bán thuốc có nguồn gốc rõ ràng. Sở Y tế Hà Nội cũng yêu cầu phòng y tế các quận, huyện, thị xã thông báo đến các cơ sở hành nghề trên địa bàn quản lý không mua bán, sử dụng thuốc Arimidex 1mg, thuốc Iressa 250mg không rõ nguồn gốc xuất xứ.
Thuốc Arimidex là thuốc có tác dụng chống ung thư vú ở phụ nữ đã qua thời kì mãn kinh và cải thiện hệ miễn dịch. Còn thuốc Iressa 250mg là thuốc được sử dụng trong điều trị ung thư phổi. Các thuốc Iressa 250mg và Arimidex 1mg không rõ nguồn gốc xuất xứ, có thông tin trên nhãn, tờ hướng dẫn sử dụng, vỉ thuốc khác biệt so với thuốc cùng tên đã được cấp giấy đăng ký lưu hành tại Việt Nam.
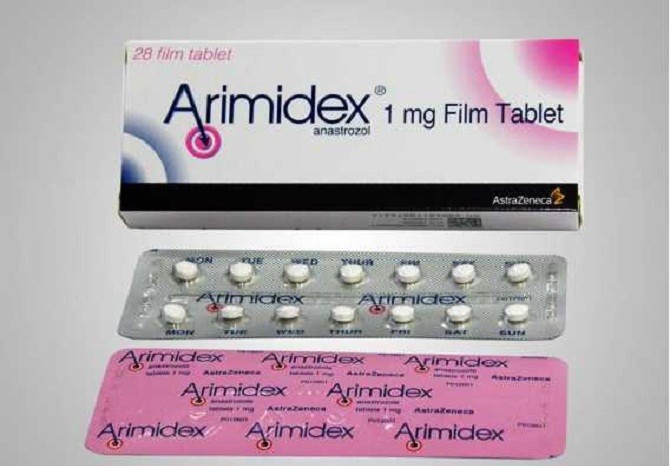
Mẫu thuốc Arimidex 1mg, SĐK VN-19784-16 ở nhãn hộp mặt trước có thông tin Rx PRESCRIPTION ONLY MEDICINE; thông tin dạng bào chế: film -coated tablets; thông tin quy cách đóng gói: 2×14 film -coated tablets (calendar pack).
Nhãn hộp mặt sau có các thông tin (thuốc bán theo đơn, dạng bào chế, tên hoạt chất và hàm lượng hoạt chất, dạng đóng gói, chỉ định, cách dùng, chống chỉ định, bảo quản, thận trọng, số lô, ngày sản xuất, hạn dùng) bằng tiếng Việt; có thông tin phân loại thuốc độc; cơ sở sản xuất AstraZeneca Pharmaceuticals LP, Hoa Kỳ; thông tin cơ sở nhập khẩu là Công ty cổ phần Dược liệu TW2; không có mã vạch. Số lô, ngày sản xuất, hạn dùng bằng tiếng Anh.
Nhãn hộp mặt bên 2 có thông tin cơ sở sản xuất bằng tiếng Anh; có thông tin cơ sở đóng gói bằng tiếng Anh; có thông tin công bố Arimidex 1mg nhãn hiệu do tập đoàn AstraZeneca sở hữu bản quyền năm 2014 bằng tiếng Anh.
Nhãn hộp mặt bên 3 có thông tin bằng tiếng Anh (chỉ định, cách dùng, chống chỉ định: xin đọc tờ hướng dẫn sử dụng); có thông tin khuyến cáo bằng tiếng Anh (không sử dụng quá liều chỉ định; đọc kỹ hướng dẫn sử dụng trước khi dùng; để xa tầm tay trẻ em; bảo quản ở nhiệt độ không quá 30 độ C). Nhãn hộp mặt bên 4 không có thông tin dạng bào chế, không thể hiện số lượng viên trong hộp. Vỉ thuốc khác biệt về mã số P041692 in trên vỉ; có thông tin cơ sở sản xuất, cơ sở đóng gói và xuất xứ bằng tiếng Việt. Tờ hướng dẫn sử dụng có thông tin bằng tiếng Việt.
Mẫu thuốc Iressa 250mg, SĐK VN-20652-17, nhãn hộp mặt trước là tên biệt dược rồi đến tên hoạt chất; khác biệt về cách trình bày thuốc kê đơn Rx PRESCRIPTION ONLY MEDICINE, thông tin quy cách đóng gói 250mg 30 tablets. Nhãn hộp mặt sau có các thông tin (hoạt chất và hàm lượng hoạt chất, dạng bào chế, dạng đóng gói, chỉ định, cách dùng, chống chỉ định, bảo quản, thận trọng) bằng tiếng Việt; có thông tin phân loại thuốc độc; nhà sản xuất AstraZeneca UK Limited.Anh; thông tin cơ sở nhập khẩu là Công ty cổ phần Dược liệu TW2; không có mã vạch.
Nhãn hộp mặt bên 1 thông tin cơ sở sản xuất bằng tiếng Anh; có thông tin công bố Iressa có nhãn hiệu do tập đoàn AstraZeneca sở hữu năm 2014 bằng tiếng Anh. Nhãn hộp mặt bên 2 có thông tin điều kiện bảo quản, thông tin liều dùng, thông tin thuốc chứa lactose bằng tiếng Anh. Nhãn hộp mặt bên 3 có tên biệt dược và tên hoạt chất "Gefitinib", quy cách đóng gói 250mg 30 tablets. Vỉ thuốc có mã số PO12182 trên túi; có thông tin số lô, ngày sản xuất, hạn dùng. Tờ hướng dẫn sử dụng in theo chiều ngang, có thông tin bằng tiếng Việt.
Thuốc Arimidex 1mg, thuốc Iressa 250mg không rõ nguồn gốc xuất xứ có thông tin hoàn toàn khác với nhận diện thuốc được cấp số đăng ký lưu hành tại Việt Nam. Cục Quản lý Dược cho biết, đơn vị này chưa cấp giấy phép nhập khẩu cho thuốc chưa có số đăng ký có tên Arimidex 1mg, Iressa 250mg nêu trên.
Trước đó, Sở Y tế cũng ra thông báo đình chỉ lưu hành và thu hồi thuốc Methylprednisolon 16mg không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan. Cụ thể thuốc viên nén Methylprednisolon 16mg bị đình chỉ lưu hành có SĐK:VD-19224-13, số lô: 804060, NSX:20.04.2018, HD: 20.04.2021, do Công ty TNHH Dược phẩm USA-NIC sản xuất.
Bảo Lâm/ VietQ